La production des biomédicaments
Fondamental : L'utilisation des biotechnologies
En raison des caractéristiques des biomédicaments (grande taille, structure complexe...), ils ne peuvent être produits par synthèse chimique.
C'est par l'utilisation d'organismes vivants (micro-organismes ou cellules) qu'ils vont être obtenus, en y introduisant un gène et en le faisant s'exprimer (technologie de l'ADN recombinant).
Le processus de fabrication va comporter de multiples étapes.
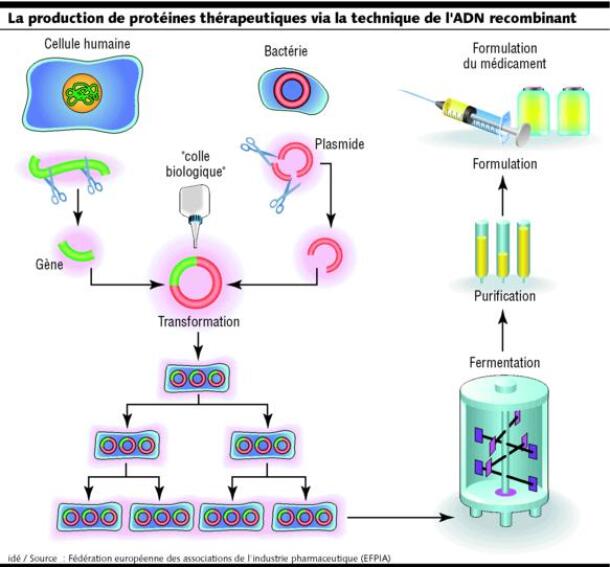
La première étape, essentielle, consiste en l'obtention d'un clone cellulaire de production qui a intégré le gène codant pour la protéine d'intérêt.
Pour ce faire, il va d'abord y avoir sélection du gène d'intérêt, qui sera introduit dans un vecteur (on parle de « vectorisation ») tels qu'un plasmide, un virus, un chromosome artificiel... pour le transfecter dans le système d'expression (cellule, bactérie...). Les systèmes ayant intégré le gène d'intérêt vont être sélectionnés et amplifiés par culture cellulaire afin de constituer des banques de cellules qui ne comportent que les clones cellulaires sélectionnés.
Ensuite, ces banques vont subir des expansions successives pour arriver à une masse cellulaire suffisante en bioréacteur, afin de rendre possible la production de la protéine d'intérêt.
Le milieu de culture va être récolté, et la protéine d'intérêt est séparée des débris cellulaires grâce à des techniques de centrifugation et de filtration.
La protéine est ensuite purifiée par des techniques chromatographiques, afin d'assurer une pureté finale proche de 99,5 %.
La substance active purifiée est finalement mise sous forme pharmaceutique avec des excipients assurant la stabilité, la biodisponibilité du médicament, ainsi que le maintien de sa qualité tout au long de sa vie.
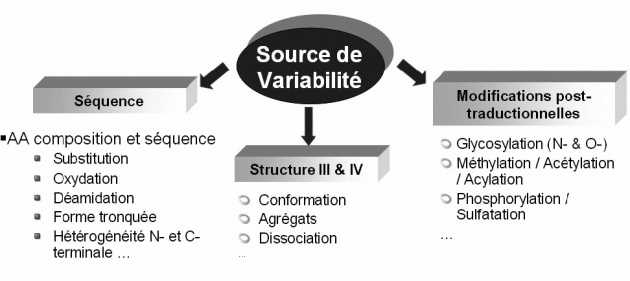
Fondamental : La variabilité des biomédicaments
Contrairement aux molécules chimiques de petite taille obtenues par synthèse chimique, qui présentent peu d'hétérogénéité, les biomédicaments sont produits avec une variabilité.
Cette variabilité peut ainsi se retrouver pour un même produit, entre différents lots.
Cette variabilité peut être expliquée par plusieurs facteurs :
le type d'organisme exprimant le gène (selon leur nature, il peut y avoir des modifications post-traductionnelles)
les conditions de croissance
le processus de purification
la formulation
les conditions de stockage et de transport
La molécule active va donc exister sous la forme de différents variants moléculaires.
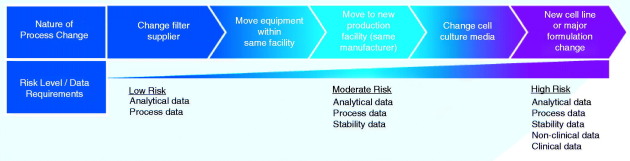
Remarque : Les modifications dans le processus de fabrication
Depuis leur première mise sur le marché, la presque totalité des médicaments biologiques ont vu leur processus de fabrication modifié. Ces changements, plus ou moins à risque (changement de marque de filtre, changement de matières premières...), font que la molécule finale est différente par rapport à précédemment.
Bien sûr, il est indispensable que ces modifications n'entraînent pas de perte d'efficacité ou de tolérance du produit.
Ces changements sont encadrés, et le laboratoire doit fournir des données pour rendre compte des conséquences sur le produit. En cas de changement à risque, des données cliniques sont nécessaires (voir le schéma ci-dessous).
Ainsi, pour un biomédicament dont le processus a été modifié, il existe une variabilité entre le produit commercialisé il y a plusieurs années, lors de la mise sur le marché, et celui fabriqué actuellement.
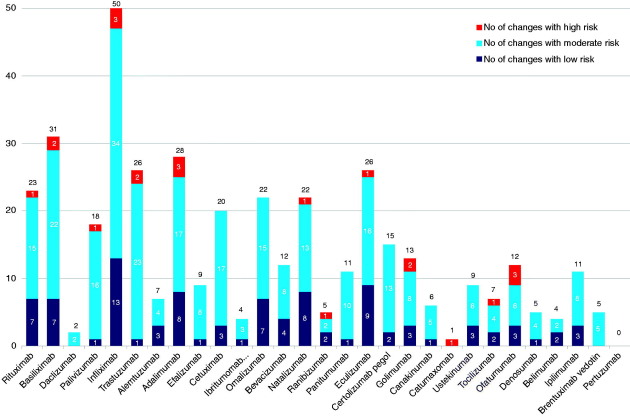
Par exemple, nous pouvons voir sur le schéma ci-dessous qu'entre le début de sa production (en 1998) et 2016, le processus de fabrication de l'infliximab (REMICADE®) a fait l'objet de 50 modifications (dont 3 "à haut risque").