Extrapolation des indications
Attention : Extrapolation non automatique
En principe, les biosimilaires sont autorisés avec les mêmes indications que le médicament de référence.
Pour une indication donnée, si la similarité clinique démontrée du biosimilaire est considérée comme étant significative, il peut être envisagé une extrapolation des données de sécurité et d'efficacité à d'autres indications du médicament de référence, sous certaines conditions.
Néanmoins, pour certaines indications, des études dédiées peuvent s'avérer indispensables, et il n'y aura donc pas d'extrapolation.
Ainsi, un médicament biosimilaire peut avoir moins d'indications que le médicament de référence.
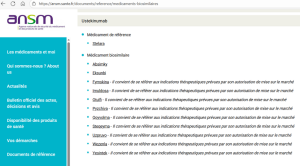
Exemple : L'infliximab
Un biosimilaire du REMICADE®, INFLECTRA®, a d'abord montré une similarité au cours d'essais réalisés chez les patients atteints de polyarthrite rhumatoïde ou de spondylarthrite ankylosante.
Au Canada, en 2014, les autorités sanitaires ont accepté l'extrapolation des données au rhumatisme psoriasique et au psoriasis en plaques demandée par le laboratoire, en se basant sur la "similitude physiopathologique de ces affections et l'équivalence du schéma posologique de l'infliximab pour ces indications."